En identifiant formellement le principal acteur de la fusion entre les deux cellules sexuelles mâle et femelle, des chercheurs de l’Institut Pasteur, du CNRS et de l’Université Paris Descartes, associés à des équipes américaines et allemandes, dévoilent l’origine virale probable de ce processus de fusion, commun à une grande partie des organismes vivants sur Terre. L’étude fournit en outre de nouvelles pistes de recherche à perspective thérapeutique, visant à bloquer cette fusion chez les pathogènes qui y ont recours, comme l’agent du paludisme. Ces résultats sont publiés le 23 février 2017 dans la revue Cell.
Depuis le début du XXe siècle, on sait que la fusion entre un gamète male et un gamète femelle constitue la première et indispensable étape de la formation de la cellule-œuf, dont les divisions successives finiront par former un organisme vivant complet. Ce processus de reproduction est utilisé chez la plupart des eucaryotes, c’est-à-dire les organismes vivants possédant des cellules avec un noyau – animaux, plantes, mais également certains parasites comme Plasmodium, l’agent du paludisme -, par opposition aux procaryotes, comme les bactéries, qui en sont dépourvus. Bien qu’essentiel, ce processus et les mécanismes moléculaires qui le sous-tendent demeuraient pourtant jusqu’à présent mal connus.
Présente à la surface de la membrane des gamètes males, la protéine HAP2, retrouvée dans presque tous les embranchements de l’arbre phylogénétique des eucaryotes, avait déjà été suspectée d’être impliquée dans le processus de fusion des cellules sexuelles. C’est sur cette dernière que se sont penchés des chercheurs de l’Institut Pasteur, du CNRS et de l’Université Paris Descartes, sous la direction de Felix Rey (unité de Virologie structurale) en collaboration avec des équipes de l’université du Texas[1] et de l’Ecole de médecine de Hanovre[2].
En déterminant la structure tridimensionnelle de la protéine HAP2 de l’algue unicellulaire Chlamydomonas, par cristallisation et diffraction aux rayons X, les scientifiques ont montré qu’elle est homologue des protéines virales de fusion dites de classe II. Cette découverte les a conduits à penser que HAP2 pourrait être l’héritage d’une infection virale ancienne, qui se serait produite chez l’ancêtre commun à l’ensemble des eucaryotes.
Les chercheurs ont alors réalisé une étude fonctionnelle poussée, sur la base des connaissances préalables du mécanisme de fusion des virus et l’homologie identifiée. Celle-ci a permis de caractériser la structure particulière de HAP2 lui permettant d’engager la fusion. Il s’agit d’une région formant une boucle à l’extérieur de la cellule, dont la modification ou le blocage empêchait directement la fusion. Cette boucle, de même nature que celle que présentent les protéines virales homologues à HAP2, est donc la région clé de la fusion entre les gamètes.
En identifiant clairement comme responsable de la fusion entre gamètes chez les eucaryotes une protéine dérivant du même gène ancestral que des protéines utilisées par certains virus (comme celui de la dengue ou de Zika) pour envahir une cellule, ces travaux suggèrent qu’un virus pourrait être à l’origine de l’apparition de la vie sexuelle sur Terre. Il reste néanmoins la possibilité qu’au contraire, ce soient les virus qui aient incorporé une protéine cellulaire pour leur permettre d’assurer cette fonction de fusion membranaire. Grâce à la mise au jour des bases moléculaires, longtemps ignorées de ce processus de fusion, les scientifiques désignent en outre HAP2 comme cible thérapeutique pour bloquer la transmission de pathogènes, qui, comme Plasmodium, responsable du paludisme, y ont recours dans leur cycle biologique.
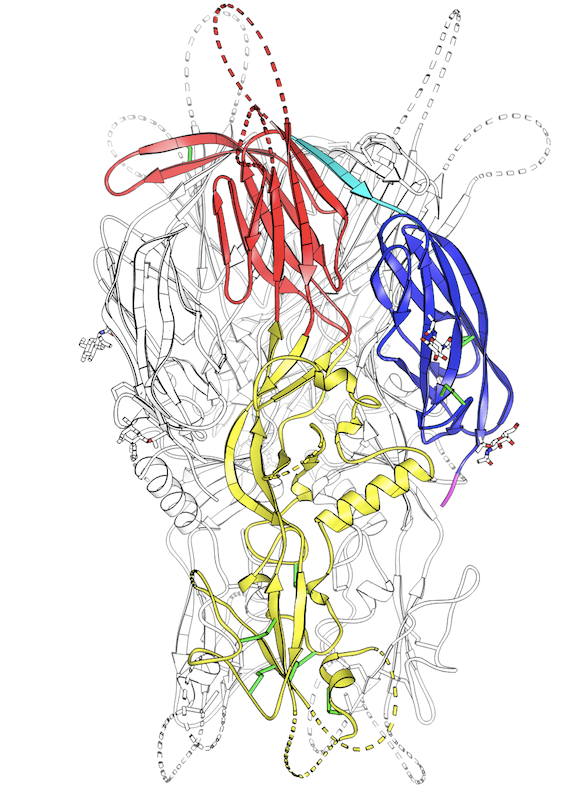 Iconographie : structure de la protéine HAP2 de l’algue verte Chlamydomonas reinhardtii. La double boucle projetée à la pointe du domaine II de HAP2 (domaine jaune) est responsable de son interaction directe avec la membrane de l’ovule. Des anticorps dirigés contre cette boucle de fusion de HAP2 sont capables de bloquer la fusion des gamètes de l’algue in vivo. ©Thomas Krey
Iconographie : structure de la protéine HAP2 de l’algue verte Chlamydomonas reinhardtii. La double boucle projetée à la pointe du domaine II de HAP2 (domaine jaune) est responsable de son interaction directe avec la membrane de l’ovule. Des anticorps dirigés contre cette boucle de fusion de HAP2 sont capables de bloquer la fusion des gamètes de l’algue in vivo. ©Thomas Krey
Source
The ancient gamete fusogen HAP2 is a eukaryotic class II fusion protein, Cell, 23 février 2017.
Juliette Fedry1,2,3,4,11, Yanjie Liu5,11, Gerard Péhau-Arnaudet6, Jimin Pei7, Wenhao Li5, M.
Alejandra Tortorici1,2, Francois Traincard8, Annalisa Meola1,2, Gerard Bricogne9, Nick Grishin7,
William J. Snell5, †,*, Félix A. Rey1,2,12,* and Thomas Krey 1,2,4,10,*
(1) Institut Pasteur, Unité de Virologie Structurale, 25-28 Rue du Docteur Roux, 75724 Paris Cedex 15, France
(2) CNRS UMR 3569, 25-28 Rue du Docteur Roux, 75724 Paris Cedex 15, France
(3) Université Paris Descartes Sorbonne Paris Cité, Institut Pasteur, Rue du Docteur Roux, 75015 Paris, France
(4) Institute of Virology, Hannover Medical School, 30625 Hannover, Germany
(5) Department of Cell Biology, University of Texas Southwestern Medical Center, 6000 Harry Hines Boulevard, Dallas, TX 75390-9039, USA
(6) Institut Pasteur, PFMU, UMR 3528, CNRS, Institut Pasteur, 25-28 rue du Docteur Roux, 75015
Paris, France
(7) Departments of Biophysics and Biochemistry and Howard Hughes Medical Institute, University of Texas Southwestern Medical Center, 6000 Harry Hines Boulevard, Dallas, TX 75390-9039, USA
(8) Institut Pasteur, Plateforme Ingenierie des Anticorps, Department Biologie Structurale et Chimie, Paris, France
(9) Global Phasing Ltd., Sheraton House, Castle Park, Cambridge CB3 0AX, UK
(10) German Center for Infection Research (DZIF)
(11) Co-first author
(12) Lead Contact
†Present address: Department of Cell Biology and Molecular Genetics, University of Maryland, College Park, MD 20742, USA
[1] Equipe de William J. Snell, Department of Cell Biology, University of Texas Southwestern Medical Center, Dallas (USA), et actuellement Department of Cell Biology and Molecular Genetics, University of Maryland, College Park, MD 20742, USA
[2] Equipe de Thomas Krey, Institute of Virology, Hannover Medical School (Germany), et Deutsches Zentrum für Infektionsforschung

 Iconographie : structure de la protéine HAP2 de l’algue verte Chlamydomonas reinhardtii. La double boucle projetée à la pointe du domaine II de HAP2 (domaine jaune) est responsable de son interaction directe avec la membrane de l’ovule. Des anticorps dirigés contre cette boucle de fusion de HAP2 sont capables de bloquer la fusion des gamètes de l’algue in vivo. ©Thomas Krey
Iconographie : structure de la protéine HAP2 de l’algue verte Chlamydomonas reinhardtii. La double boucle projetée à la pointe du domaine II de HAP2 (domaine jaune) est responsable de son interaction directe avec la membrane de l’ovule. Des anticorps dirigés contre cette boucle de fusion de HAP2 sont capables de bloquer la fusion des gamètes de l’algue in vivo. ©Thomas Krey