Santé humaine
Communiqué de presse
Choc endotoxique : le rôle protecteur des cellules immunitaires neutrophiles
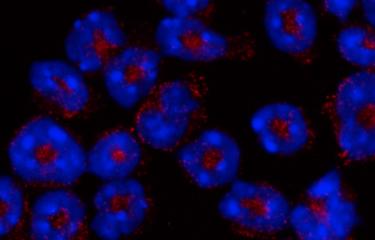
| Neutrophiles dont le noyau multilobé est coloré en bleu. En rouge, la myéloperoxidase (MPO), contenue dans des granules cytoplasmiques
©Institut Pasteur
|
Des chercheurs de l’Institut Pasteur et de l’Inserm, en collaboration avec l’université de Stanford, viennent de démontrer le rôle protecteur des cellules immunitaires appelées polynucléaires neutrophiles dans le choc endotoxique, la composante du choc septique liée à l’action des toxines bactériennes. Cet effet reposerait sur la principale enzyme produite par ces cellules : la myéloperoxidase. Cette découverte est dans The Journal of Experimental Medecine. |
Responsable de 50% des décès en réanimation, le choc septique est une défaillance circulatoire aiguë, due à une réponse inflammatoire incontrôlée, intervenant dans un contexte d’infection grave. Le choc septique implique, entre autres mécanimes, le choc endotoxique : celui-ci est plus particulièrement dû à l’action des toxines produites par les bactéries responsables de l’infection. Parmi ces toxines, les lipopolysaccharides (LPS) sont les principaux acteurs du choc endotoxique : ce sont eux qui déclenchent la cascade immunitaire excessive, prolongée et déséquilibrée à l’origine de la défaillance multi-viscérale.
Parmi l’arsenal immunitaire de l’organisme pour lutter contre les infections bactériennes, les polynucléaires neutrophiles, des globules blancs impliqués dans la réponse immunitaire innée, ont déjà été décrits comme ayant une activité antimicrobienne. Cependant, la communauté scientifique pensait qu’ils pouvaient également avoir un rôle délétère, lors de l’exposition de l’organisme à des toxines bactériennes comme les LPS. Ils étaient en effet supposés exacerber l’inflammation et les dommages tissulaires associés à une exposition aux LPS.
Des chercheurs de l’unité « Anticorps en thérapie et pathologie » (Institut Pasteur/Inserm), en collaboration avec l’université de Stanford, ont observé qu’au contraire, ces neutrophiles jouaient un rôle protecteur contre l’inflammation déclenchée par le LPS. Les chercheurs ont pour cela construit le premier modèle murin permettant une diminution très sélective du nombre de neutrophiles, et ce de manière inductible et réversible. Ils ont ainsi montré qu’une déplétion des neutrophiles rendait les souris plus susceptibles aux effets toxiques du LPS, diminuant leur survie et activant fortement leur production de cytokines, les molécules messagères de l’inflammation.
Plus en détail, les chercheurs montrent que cette capacité protectrice des neutrophiles est due à la myéloperoxidase (MPO), la principale enzyme produite par ces cellules. « Cette protéine, pourtant couramment utilisée comme marqueur d’inflammation, ne la démultiplie pas, souligne Laurent Reber, premier auteur de ce travail. Au contraire, elle joue un rôle protecteur ». « Les patients qui ont des niveaux de MPO bas ont d’ailleurs un plus mauvais pronostic en cas de choc septique », ajoute Caitlin Gillis, également co-premier auteur du papier.
« Nous avons en quelque sorte résolu un paradoxe, conclue Laurent Reber. Les neutrophiles associent bien, de manière cohérente, un caractère antimicrobien et une capacité à limiter la toxicité des bactéries. Le modèle animal que nous avons développé va désormais nous permettre d’explorer de manière plus large la fonction des neutrophiles dans des mécanismes d’immunité innée et adaptative. Nous allons aussi essayer de comprendre comment agit la MPO vis-à-vis du LPS et pourquoi elle n’a aucun effet sur d’autres toxines bactériennes ».
Ce travail a bénéficié de financements de l’Institut Pasteur, de l’Inserm, de l’université de Stanford, de l’ERC (projet MyeloSHOCK) et du NIH.
Neutrophil myeloperoxidase diminishes the toxic effects and mortality induced by lipopolysaccharide, The Journal of Experimental Medecine, 1er mai 2017.
DOI : 10.1084/jem.20161238
Laurent L. Reber (1,2,8,10)*, Caitlin M. Gillis (8,10)*, Philipp Starkl (1,2), Friederike Jönsson (8,10), Riccardo Sibilano (1,2), Thomas Marichal (1,2), Nicolas Gaudenzio (1,2), Marion Bérard (9), Stephan Rogalla (3,4), Christopher H. Contag (3,4,5,6,7), Pierre Bruhns (8,10)** et Stephen J. Galli (1,2,5).**
- (1) Department of Pathology,
- (2) Sean N. Parker Center for Allergy and Asthma Research,
- (3) Department of Pediatrics, Division of Neonatology,
- (4) Molecular Imaging Program at Stanford
- (5) Department of Microbiology and Immunology,
- (6)Department of Radiology,
- (7) Department of Bioengineering, Stanford University School of Medicine, Stanford, CA 94305
- (8) Department of Immunology, Unit of Antibodies in Therapy and Pathology and
- (9) Animalerie Centrale, Institut Pasteur, 75015 Paris, France
- (10) Institut National de la Santé et de la Recherche Médicale, U1222, 75015 Paris, France
* / ** : contribution égale de ces auteurs

